Как нейтрализовать каустическую соду: меры предосторожности, первая помощь, отзывы
Каустическая сода или едкий натр – это разновидность гидрокарбоната натрия, широко применяемого для промышленных и бытовых целей. Данное вещество отличается высокой эффективностью при удалении жирных пятен с одежды, чистке канализационных труб и различных поверхностей, а также мытье посуды.
Мнение эксперта
Совет!
В процессе использования каустической соды нужно соблюдать основные правила безопасности, так как ее неправильное применение может привести к травмированию и нарушению целостности кожных покровов.
Что такое каустическая сода
Каустической содой называется щелочь, имеющая порошковую консистенцию, способную растворяться в воде, не имеющую ярко выраженного запаха. На сегодняшний день вещество выпускается в форме порошка или жидкости.

Основные сферы использования едкого натра:
- газовая;
- нефтяная;
- животноводческая и сельскохозяйственная;
- металлургическая;
- химическая;
- автомобильная;
- легкая и текстильная;
- бытовая.
Каустический химикат применяется при изготовлении бумажной продукции, в качестве проявителя для фотографий, а также в фармацевтической, парфюмерно-косметической продукции.
Основное отличие гидрокарбоната натрия от пищевой соды заключается в его химической формуле – если для пищевого продукта она выглядит как NaHCO3, то для едкого натра NaОН.

Особенности каустической соды
Каустическая сода нашла широкое применение благодаря своим свойствам и особенностям. Она считается эффективным вариантом для очищения различных поверхностей и систем, питьевая сода не способна справиться с серьезными засорами.
- Способна вступать в реакцию с оловом, алюминием, цинком и другими легкими металлами, а также их сплавами.
- Разъедает бумажные изделия, ткани, кожу, волосы, жир и остатки пищи.
- Растворяется в этиловом спирте и глицерине.
- Способствует разрушению стекла и фарфора.
В отличие от натрия двууглекислого, едкий натр не используется в кулинарных целях, так как относится к веществам повышенного уровня опасности. Применение данного компонента в быту заключается в дезинфекции помещений, промывке предметов посуды и кафеля, а также очистке труб канализационной и отопительной систем и засоров.
Осторожность при использовании
При использовании гидрокарбоната натрия необходимо соблюдать все меры личной безопасности, так как химикат может нанести серьезный вред здоровью и вызвать тяжелые последствия для организма.
В случае попадания ядовитого вещества на кожу лица или тела возможно появление химических ожогов, болезненных экзем и язв. При применении едкого натра нужно внимательно следить за тем, чтобы он не попал в глаза, так как это может привести к стремительному некрозу глазной роговицы и утрате зрения.

Случайное проглатывание или вдыхание паров жидкой гидрокарбоната натрия заканчивается сильными ожогами и повреждениями слизистой поверхности гортани и пищевода. В таких случаях пострадавшему нужно незамедлительно оказать первую помощь.
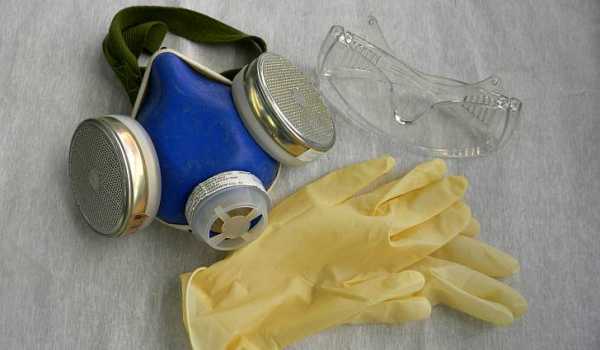
При использовании ядовитого натра обязательно нужно использовать защитные очки, резиновые перчатки и маска.
Очищение труб при помощи едкого натра
Каустическая сода способна очистить трубы канализационных или отопительных систем от самых сложных засоров, вне зависимости от сроков их давности. Для приготовления очищающего раствора следует соблюдать такие пропорции: 2-3 кг каустической соды в форме порошка, 6-7 л холодной воды.
Едкий натр высыпают в ведро с толстыми пластиковыми стенками, заливают указанным объемом холодной воды, тщательно размешивают. Далее примерно половину ведра приготовленного раствора нужно влить в сливное отверстие и оставить на 2-3 часа.
При этом, необходимо внимательно следить за тем, чтобы каустическая сода не пролилась на пластик или кафель, так как это может привести к их разрушению.
Спустя указанный период времени в сливное отверстие выливают вторую половину гидрокарбоната натрия и оставляют еще на несколько часов. После этого включают воду для того, чтобы она на протяжении 20 минут сливалась в отверстие и смыла каустик.
При слабых засорах можно залить сразу весь приготовленный раствор, не разделяя его на две половины. При использовании каустической соды обязательно нужно открыть окна в помещении.
Нейтрализация каустической соды
Для нейтрализации остатков гидрокарбоната натрия используется раствор уксусной или лимонной кислоты. Также с этой целью можно применить раствор борной кислоты, который продается в любой аптеке.
Рецепт приготовления средства:
- В случае химического ожога кожи – промыть раствором борной кислоты крепостью 2%, затем большим количеством чистой, проточной воды.
- Приготовить 5% уксусный раствор – для этого необходимо размешать ложку уксусной кислоты 70% в 13 ложках очищенной воды.
Важно помнить, что даже после обработки поврежденных участков тела кислотными растворами, обязательно нужно обратиться за помощью к врачу.

Оказание первой помощи
Своевременная и правильно оказанная первая помощь – залог того, что человек, пострадавший от контакта с токсическим компонентом не столкнется с тяжелыми, необратимыми последствиями.
- в случае проглатывания раствора едкого натра или вдыхания его испарений – дать пострадавшему выпить большое количество жидкости, после чего нажать пальцами на корень языка, вызывая приступ рвоты;
- ожог кожных покровов – на протяжении 10-15 минут держать пораженную часть тела под струей проточной воды или слабого уксусного раствора;
- попадания в глаза – удалить гидрокарбонат натрия при помощи промывания глаз обильным количеством чистой воды.
В случае, если помощь будет оказана слишком поздно, возможна полная атрофия зрительного нерва и необратимая потеря зрения.
Отзывы
Михаил, Екатеринбург:
Давно пользуюсь едким натром для прочистки канализационных труб и сливной ямы на даче. Средство очень эффективно, но самое главное – это правильно его приготовить и соблюдать все меры предосторожности. Кроме того, к преимуществам вещества отнесу доступную стоимость и легкость в применении.
Павел, Калуга:
Однажды, наслушавшись советов друга, решил почистить слив в ванной едким натром. Но случайно разлил раствор себе на руку. К счастью, рядом оказалась лимонная кислота – я развел ее водой и промыл руку, после чего минут 10-15 держал под потоком воды из крана. Это помогло мне избежать серьезных ожогов.
Наталья, Сочи:
Использую этот химикат для мытья посуды с застаревшим жиром – она отлично справляется с этой проблемой. Самое основное при работе с гидрокарбонатом натрия – это обязательно надевать плотные резиновые перчатки и защитную маску. Я еще дополнительно пользуюсь очками, которые оберегают мои глаза от возможных химических ожогов. Пока что никаких проблем не возникало.
Каустическая сода – это мощное химическое вещество, которое широко применяется для устранения сложных загрязнений в отопительных и канализационных системах, стирки одежды, мытья посуды. При контакте с едким натром, который относится к категории ядовитых химикатов, необходимо пользоваться средствами, защищающими кожные покровы и глаза человека от тяжелых ожогов и травм.
А Вы поделились статьей с друзьями?
ДаНет
soda-soda.ru
Натр едкий приготовление растворов — Справочник химика 21
Натр едкий, титрованные растворы. В фарфоровый стакан отмеряют 500 мл воды и растворяют 800 г едкого натра. Полученный раствор сливают в бутыль и оставляют стоять на несколько дней. За это время сода, содержащаяся в едком натре, выпадает в осадок, а в прозрачном растворе остается едкий натр. Этот раствор, имеющий при 20° С удельный вес 1,525, используют для приготовления растворов едкого натра меньшей концентрации. В приведенной таблице указаны объемы насыщенного раствора едкого натра, мл, которые нужно довести до 1 л, чтобы получить раствор требуемой концентрации [c.285]Приготовление раствора едкого натра [c.145]
Ход определения. Пробу анализируемого раствора количественно переносят в мерную колбу на 100 мл, разбавляют дистиллированной водой до метки и тщательно перемешивают. В колбу для титрования переносят мерной пипеткой 5,0 мл приготовленного раствора, добавляют каплю метилового оранжевого и титруют рабочим раствором едкого натра до перехода окраски из розовой в желтую. Записывают показание бюретки. К раствору в колбе добавляют 1 мл глицерина, 1—2 капли фенолфталеина и продолжают титрование щелочью до перехода окраски из желтой в оранжевую. Если оранжевая окраска оказывается неустойчивой, добавляют еще 1 мл глицерина и дотитровывают раствор. Записывают новое показание бюретки. Опыт повторяют не менее 4—5 раз. Данные титрования записывают в таблицу по форме
Приготовление растворов едкого натра. Для получения растворов едкого натра, свободных от карбонатов, навеску едкого натра растворяют в равном по весу количестве дистиллированной воды и раствору дают отстояться в течение 5—10 дней. Раствор ш,елочи должен быть прозрачным и не должен содержать взвешенных частиц. Прозрачный раствор декантируют и определяют содержание в нем едкого натра. Затем приготовленный раствор разбавляют дистиллированной водой до получения растворов указанной концентрации. Концентрацию растворов едкого натра устанавливают титрованием с фенолфталеином и метиловым оранжевым. Пробы растворов для титрования отбирают с помощью пипетки и взвешивают. Растворы готовят в фарфоровой посуде и хранят в склянках с резиновыми пробками. [c.147]
Пример. Из 600 л раствора концентрацией 200 г/л нужно приготовить, раствор концентрацией 85 г/л. В 600 л раствора содержится 200 X 600 = = 120 000 г, или 120./сг едкого натра. Для приготовления раствора заданной концентрации это количество едкого натра нужно растворить а 120 000 85 = 1411 д воды, т. е. в смеситель с раствором нужно добавить еще 1411 —600 = 811 л во[c.20]
Для установления точной концентрации раствора едкого натра им титруют раствор щавелевой кислоты, приготовленной из фиксанала, в присутствии фенолфталеина. Появляющееся в конце титрования розовое окрашивание не должно исчезать в течение 10—15 сек. [c.255]
Для приготовления раствора едкого натра рассчитывают навеску с точностью до 0,01 г и увеличивают результат на 10%. Навеску в стакане, в котором производили взвешивание, ополаскивают холодной водой для растворения карбоната натрия на поверхности твердого вещества. Слив первую порцию воды, растворяют оставшееся [c.111]
Раствор едкого натра 0,1 н. В 1 л раствора указанной концентрации должно содержаться 4 г едкого натра. Для приготовления 10 л раствора следует отвесить 40 г едкого натра и растворить его в 10 л дистиллированной воды. После растворения раствор в бутыли тщательно перемешать. [c.255]
Оборудование и реактивы. Коническая колба на 300 мл с притертой пробкой. Капельница с притертой пробкой. Мерные цилиндры на 100 мл. Пипетки на 1, 2 и 10 мл. Анилин (3%-ный раствор если имеет темную окраску, перед приготовлением раствора его перегоняют). Пиридин. Едкий натр (0,5 н. раствор, не содержащий карбонатов титр раствора устанавливают титрованием кислоты щелочью в присутствии фенолфталеина). Дистиллированная вода. Фенолфталеин (0,1%-ный спиртовый раствор). [c.181]
Для вычисления молярного отношения между фенолом и едким натром в приготовленном растворе фенолятов средняя молекулярная масса смеси фенолов принята равной 100. [c.43]
Приготовление. Растворяют 1 г нитрата серебра в 10 мл воды, раствор хранят в темноте. Перед употреблением небольшое количество этого раствора смешивают с равным объемом раствора I г едкого натра в 10 мл воды, выпавший осадок окиси серебра растворяют, осторожно добавляя концентрированный раствор аммиака. [c.368]
Для приготовления суспензий использованы 17 тонкодисперсных порошков, в частности карбонил железа, карбонат кальция, двуокись титана, тальк, активированный уголь и разбавленные водные растворы сульфата алюминия, фосфата натрия, едкого натра, а также дистиллированная вода. При помощи электронного микроскопа предварительно были определены размер и форма частиц тонкодисперсных порошков в сухом состоянии измерением проницаемости при фильтровании воздуха — удельные поверхности частиц этих порошков. При этом найдено, что средний размер частиц различных порошков составляет 0,1 —10 мкм, форма их изменяется от шарообразной (у карбонила железа) до очень неправильной (у талька), а удельная поверхность частиц находится в пределах от 1,2-10 (у карбонила железа) до 20-10 м -м (у двуокиси титана).
Определение 2,4-д и н и т р о ф е н о л а в растворе. К анализируемому раствору, содержащему 2,4-динитрофенол, добавляют 20 мл 5%-ного раствора едкого натра и доводят объем раствора до 50 мл дистиллированной водой. Приготовленный раствор фотометрируют относительно раствора сравнения с выбранным светофильтром. Измерения повторяют пять раз и по среднему значению поглощения, пользуясь градуировочным графиком, находят содержание 2,4-динитрофенола в анализируемом растворе. [c.74]
Технологические установки НПЗ и НХЗ зачастую применяют реагенты более низкой концентрации, чем та, с которой они изготавливаются, поэтому в составе реагентных хозяйств проектируются узлы разбавления реагентов. Так, в частности, следует предусматривать приготовление растворов едкого натра концентрацией 10% (масс.) из 42%-ГО раствора, растворов моноэтаноламина концентрацией 10—15% (масс.). [c.138]
Определение содержания фенола и крезола в маслах (ГОСТ 1057-59)-Пробу нефтепродукта хорошо перемешивают в течение 5 мин. встряхиванием в склянке, заполненной не более чем на емкости. Отвешивают 250 г испытуемого продукта с точностью 0,1 г. Навеску переводят в делительную воронку на 1 л и растворяют в 50 мл петролейного эфира. К приготовленному раствору приливают 125 мл раствора едкого натра и содержимое воронки энергично перемешивают встряхиванием ее. Содержимому воронки дают отсто
Установка растворения едкого натра (каустической соды, гидроксида натрия)
Едкий натр (другие названия: гидроксид натрия, каустик, каустическая сода, едкая щёлочь, натриевая щелочь) – пожалуй, наиболее распространённая щелочь. Ежегодно на планете производится и потребляется около 57 000 000 тонн каустической соды. Представляет собой белое (иногда бесцветное) порошкообразное вещество.
Кроме твердого состояния существует еще водный раствор едкого натра. Формула аналогична формуле кристаллического натра (NaOH). Раствор натра более удобен в применении, поэтому каустическая сода чаще всего используется в виде раствора. По свойствам раствор не уступает твердому гидроксиду натрия, а в некоторых случаях превосходит его. Раствор едкого натра неудобен, опасен, дорог в транспортировке. Поэтому лучше перевозить в сухом состоянии. Но здесь возникает вопрос приготовления раствора на предприятии, т.к. процесс растворения едкого натра в воде небезопасен.
Сэкономьте бюджет предприятия, купив установку для приготовления раствора едкого натра!
КВАНТ МИНЕРАЛ разработал установку для безопасного растворения едкого натра в воде. Установка приготовления раствора каустической соды окупается достаточно быстро (сравните стоимость готового раствора гидроксида натрия со стоимостью установки приготовления натра) и подходит для эксплуатации в следующих отраслях промышленности:
- автомобильная (едкий натр применяется при производстве щелочных аккумуляторов)
- пищевая (в качестве пищевой добавки, для очистки оборудования)
- целлюлозная промышленность (изготовления картона, бумаги, древесно-волоконных плит и пр.)
- химическая (для нейтрализации кислот, производства моющих средств и различных масел, титрования алюминия, получения чистых металлов, солей, оснований и органических соединений; едкий натр применяется также в качестве катализатора реакций)
- синтез биотоплива
- дегазация и нейтрализация отравляющих веществ
- фармакология (производство лекарств)
- производство стекла
- легкая (едкий натр используется при производстве шелка, а также в качестве отбеливателя для тканей)
По нашим расчетам потребление электрической энергии на производство 1 тонны 46% раствора едкого натра составляет 14,5 кВт*ч.
УЗНАТЬ СТОИМОСТЬ КУПИТЬХимические свойства едкого натра.
Химическая формула едкого натра NaOH. Гидроксид натрия состоит из двух ионов: катиона натрия (Na+) и гидроксид-аниона (OH−). Эти ионы формируют едкий натр, связываясь между собой за счет электростатического притяжения разнозаряженных частиц. В растворе едкий натр полностью диссоциирует на ионы – является мощным электролитом. Водные растворы каустика проявляют сильную щелочную реакцию (pH 1%-раствора = 13). Основным методом определения едкого натра в растворе является реакция на гидроксид-ион (OH−). Чем больше гидроксид-ионов в растворе щелочи, тем щелочь сильнее и индикатор интенсивнее проявляет цвет.
Каустик вступает в реакцию с амфотерными оксидами, кислотами, кислотными оксидами, гидроксидами, солями, серой, фосфором, галогенами, металлами, амидами, эфирами, галогензамещенными алканами.
Физические свойства едкого натра.
Едкий натр на ощупь проявляется как твердое вещество, так и жидкое (мылкое). Чаще всего в форме крупных кристаллов (иногда мелкокристаллического порошка или хлопьев). Низкая температура плавления – 65,1оС. Быстро поглощает влагу и переходит в гидратированную форму (NaOH*3,5Н2О). При этом температура плавления становится еще меньше – 15,5оС. Растворяется в спиртах и воде практически в неограниченных количествах. Вследствие гидротации положительно заряженных ионов натрия, при растворении едкого натра в воде выделяется значительное количество тепла (10 ккал/моль) . В концентрированном и разбавленном виде едкий натр весьма опасен, вызывает сильный химический ожог (попадание каустика в глаза может закончиться слепотой).
Способы получения едкого натра (NaOH).
- Известковый способ – заключается в реакции между гашеной известью и карбонатом натрия при температуре 80оС. В результате образуются гидроксид натрия и карбоната. Соль выпадает в осадок, ее нужно отделить, а оставшийся раствор выпарить.
- Ферритный способ – при высокой температуре карбонат натрия спекают с трехвалентным оксидом железа. Образовавшийся феррит натрия подвергают воздействию воды. NaFeO2 разлагается с образованием едкого натра и смеси железа с водой (Fe2O3*h3O). Полученную каустическую соду из раствора выпаривают до белых кристаллов. Чистота составляет каустика составляет около 92%.
- Промышленный способ. С помощью установки электролизера – диафрагменным или мембранным способом. В установку подается раствор поваренной соли (NaCl). Под воздействием электролиза образовывается газообразный свободный хлор и каустическая сода.
Растворение едкого натра (каустической соды) в воде (видео)
kvantmineral.com
Каустическая сода Едкий натр концентрация
В 8,6 кг воды было растворено 3,4 кг каустической соды (техническое название едкого натра) с содержанием 97,2% NaOH. Определить процентную концентрацию едкого натра в растворе. [c.23]На некоторых заводах концентрирование диафрагменной каустической соды производится в двухступенчатом выпарном аппарате, из- готовленном из никеля. Слабый раствор каустической соды предварительно упаривается до 12,5% в аппарате пленочного типа, а затем последовательно проходит первый испаритель, отстойник для отделения Na l и второй испаритель. Концентрация раствора едкого натра на выходе — 50 %. [c.401]
Расчет навески. Прежде чем приступить к анализу, нужно рассчитать величину навески. Для лучшей сходимости результатов рекомендуется приготовлять большие объемы анализируемого раствора (0,5—1,0 л). Концентрация раствора всегда должна быть близкой к концентрации рабочего раствора (в данном случае 0,1 н.). Следовательно, для приготовления 0,5 л раствора нужно взять навеску 40.0,5-0,1=2 г, считая, что каустическая сода является почти чистым едким натром NaOH. [c.298]
Жидкая каустическая сода выпускается в виде водного раствора, содержащего 42% NaOH, плотность такого раствора 1,449 г/см . Данные о плотности водных растворов едкого натра различной концентрации приведены в Приложении 1. [c.63]
Раствор едкого натрия необходимой концентрации готовится либо путем разбавления поступающего на завод концентрированного раствора едкого натрия, либо путем растворения твердой каустической соды а специальном растворителе 12 паром. [c.350]
Натр едкий (К аОН) имеется в цехах в твердом виде и в виде 2—3°/о-ных водных растворов. Применяется для очистки газа от СО2 и НгЗ. Растворы едкого натра (каустической соды) вызывают химичеокие ожоги кожи. Действие раствора тем сильнее, чем выше его концентрация и температура. При попадании щелочи на кожу следует обмыть пораженный участок большим количеством воды под напором. Особенно опасно попадание едкого натра В глаза. При попадании щелочи в глаза необходимо промыть их струей чистой воды, затем 2— 2,5°/о-ным раствором борной кислоты, снова водой, закапать касторовое масло и обратиться в медпункт. ПДК щелочных аэрозолей в пересчете на едкий натр — 0,5 мг/м1 [c.23]
При работе с твердым и жидким едким натром любой концентрации необходимо быть крайне осторожным. К работе следует приступать только в специальной одежде (хлопчатобумажные брюки и куртка), резиновых сапогах или галошах, в резиновых перчатках и головном уборе. Глаза должны быть защищены предохранительными очками. При наливании или растворении каустической соды необходимо дополнительно одевать резиновый фартук. [c.25]
Увеличивая скорость протекания анолита, можно снизить или почти полностью устранить миграцию гидроксильных ионов под действием постоянного тока из катодного в анодное пространство навстречу потоку анолита. При этом будет происходить нежелательное снижение концентрации щелочи. С уменьшением концентрации едкого натра в католите увеличиваются затраты на его переработку в товарную каустическую соду. С большим количеством анолита в катодное пространство будет переноситься также значительное количество растворенного хлора, который взаимодействует со щелочью, образуя гипохлорит, восстанавливающийся на катоде. Поэтому выбирают такие условия процесса электролиза, при которых суммарные потери выхода по току из-за миграции гидроксильных ионов и проникания хлора в катодное пространство будут наименьшими. [c.211]
Автоматически регулируются также уровень жидкости во всех выпарных аппаратах, концентрация едкого натра в аппаратах, из которых отводится средний щелок и окончательно упаренный раствор каустической соды, расход воды на барометрические конденсаторы (по температуре отходящей воды), охлаждение каустической соды. [c.312]
Количество и концентрация свежей щелочи, поступающей на орошение, зависят от объема перерабатываемой воды и содержания в ней фенолов. Свежую щелочь приготавливают из концентрированного раствора каустической соды, реже применяют твердый едкий натр (92—95%-ный). На ряде установок используют раствор регенерированной щелочи, получаемой при переработке фенолятов. [c.83]
Все растворы (щелока), полученные при электролизе поваренной соли в диафрагменных ваннах с твердым катодом, а также ферритным и известковым способами, икеют низкую концентрацию едкого натра и содержат примеси — поваренную соль (в электролитических щелоках) и соду (при химических способах производства каустической соды). Такие растворы не могут быть использованы в производствах, потребляющих едкий натр. Перевозка разбавленных растворов NaOH с примесями соли и соды привела бы к непроизводительным затратам и излишней загрузке транспорта. Так, при транспортировании электролитического щелока на 1 т едкого натра пришлось бы перевозить около 9 т балласта — воды и соли. [c.296]
Количество воды, которую нужно выпарить для получения 40%-ного раствора едкого натра (576 г л, уд. в. 1,43 г см ) при подаче на выпаривание слабого щелока с концентрацией 10% (110 г л, уд. в. 1,11 г см ), составляет на 1 т 92%-ной каустической соды [c.151]
Если мощность установки достаточна, то достигается температура, при которой образуется раствор щелочи такой высокой концентрация, какая соответствует парциальному давлению водяного пара над этим раствором при данной температуре. Опыт показывает, что таким способом можно получить плавленую каустическую соду непосредственно из разлагателя амальгамы [732]. Так, при мощности установки 15 ка температуру в разлагателе можно повысить до 285°С и получить 85%-ный расплав едкого натра. Более концентрированный расплав можно получить в более мощной установке. [c.141]
Последнее время в ваннах с ртутным катодом уделяется особенное внимание вопросу повышения концентрации вытекающей каустической соды. Так, например, применяя для разложения амальгамы в пиле вместо чугунных решеток графитовые палочки, как это делает в своих ваннах Вильдерман (см. ниже), можно значительно ускорить разложение амальгамы и получить щелок более высокой концентрации, в частности до 500—6С0 г и выше в литре едкого натра. У нас в Союзе такие опыты успешно осуществил в заводском масштабе инж. В. В. Стендер. Значительно ускоряет процесс разложения амальгамы присутствие некоторых катализаторов. Вопрос находится еще в стадии изучения. В Союзе этим вопросом занимается проф.М. А.Рабинович (Киев-Харьков). [c.164]
Образовавшийся карбонат кальция осаждается и отделяется от раствора едкого натра. Концентрация едкого натра в растворе 90—135 г л. Его упаривают до концентрации NaOH, соответствующей требованиям ГОСТ на жидкую каустическую соду (42—43%). Непрореагировавшая
www.chem21.info
Очистка самогона каустической содой
Как очистить самогон каустической содой
Очистка самогона каустической содой (едким натром) — то же самое, что очистка пищевой содой, или кальцинированной. По сути данная статья призвана развеять заблуждения, возникающие из-за непонимания понятий и процессов, а заодно приоткроем завесу над дозировками. Сразу скажу, что переписываемые на различных сайтах методики по очистке самогона содой, потом марганцовкой, а потом еще каустической содой — бред, извините, сивой кобылы. Это как «масло масляное». Или разводить самогон водой, а потом еще раз водой. Потому что берем мы соду пищевую, кальцинированную, или каустик — разницы никакой — все вышеперечисленное — щелочь, и отличие только в дозировке.
Химическая сторона процесса очистки
Давайте, чтобы в дальнейшем не путаться, сразу вспомним школьный курс химии, и расставим все точки над i:

1). NaHCO3 — пищевая сода. Также в обиходе может называться питьевая сода или чайная сода. Если оперировать химическими терминами, то это гидрокарбонат натрия или натрий двууглекислый.
2). Na2CO3 — кальцинированная сода, или же карбонат натрия

3). NaOH — каустическая сода, она же каустик, едкий натр, едкая щёлочь.
Теперь давайте окунемся в формулы происходящего:
Щелочь в этой реакции нам нужна для нейтрализации кислот, содержащихся в продукте — муравьиной и уксусной. Давайте посмотрим на примере муравьиной кислоты. Возьмем по очереди все три варианта — пищевую соду, кальцинированную и каустическую.
HCOOH + NaHCO3 → HCOONa + h30 + CO2
2HCOOH + NaHCO3 → 2HCOONa + h3O + CO2
HCOOH + NaOH → HCOONa+h3O
то есть какую бы соду мы не добавляем к муравьиной кислоте — реакция одна и та же — кислота разлагается на воду и соль. В нашем случае соль — это формиат натрия (натриевая соль муравьиной кислоты) которая и выпадает в виде осадка.
В отличии от марганцовки, передозировка которой нежелательна, с содой проще — оставшаяся после реакции с кислотами щелочь дальше со спиртом не реагирует, и спокойно отсекается при второй перегонке. Вторая перегонка здесь необходима, поскольку соль полностью в осадок не выпадает и частично остается в растворе, и без перегонки мы получим самогон с незабываемым привкусом соды и солей органических кислот — поверьте, не самый лучший ароматизатор.
Итак, мы выяснили, что использовать можно любую соду — отличия в дозировках, давайте же выясним пропорции.
Для того, чтобы получить 1% раствор гидроксида натрия, надо в 100 г воды растворить 1 г NaOH.
Если растворить 1 г пищевой соды, то получится приблизительно 0,47% раствор NaOH.
Если растворить 1 г кальцинированной соды, получится 0,75% раствор NaOH.
Нас же в свою очередь интересуют обратные пропорции, то есть если мы используем вместо пищевой соды каустическую или кальцинированную, нужно соблюдать следующие пропорции.
Если используется каустическая сода, вместо 1 грамма NaHCO3 мы берем 0,47 гр. NaOH
Если мы используем кальцинированную, то вместо 1 грамма NaHCO3, берем 0,75 гр. Na2CO3
Экзотические варианты вроде декагидрата карбоната натрия — Na2CO3•10h3O — стиральной соды я думаю рассматривать нет смысла, потому что любой из рассмотренных выше трех вариантов дешев и легкодоступен в обычном продуктовом или промтоварном магазине.
samogonka.org
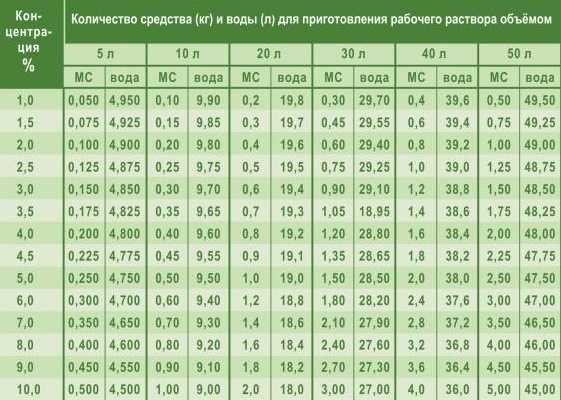
Как приготовить 1, 2, 3, 5 и 10% содовый раствор?
Гидрокарбонат натрия чаще всего применяется в виде содового раствора. О полезных свойствах соды человечеству известно стало не так давно, но содовый раствор уже активно применяется во многих сферах жизни человека, лишний раз показывая свой положительный эффект.
 Рецепты содовых растворов, которые помогают преодолеть болезни, очень просты и доступны всем
Рецепты содовых растворов, которые помогают преодолеть болезни, очень просты и доступны всемКак приготовить и где применять средство
Раствор соды получил широкое применение в различных областях человеческой деятельности. Сам бикарбонат натрия в сухом виде применяется и в промышленности, и в кулинарии, а вот содовый раствор больше всего востребован в садоводстве, медицине и косметологии.
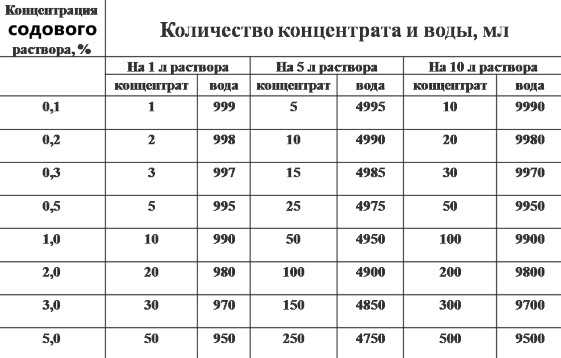
Приготовить средство очень легко – необходимое количество белого порошка добавляется в жидкость и перемешивается до полного растворения частичек. Чаще всего соду размешивают в воде, однако для лечения некоторых недугов гидрокарбонат натрия полезнее с молоком, нежели с водой. А вот в косметологии раствор соды делается на основе шампуня, которым моют волосы.
Несмотря на то что сделать содовый раствор легко, при его приготовлении важно правильно соблюдать пропорции рекомендуемых веществ.
В противном случае средство может стать не только бесполезным, но и вредным.
Применение в садоводстве
Для сада и огорода раствор пищевой соды незаменим. С его помощью можно:
- избавиться от мучнистой росы – заболевания многих культурных растений, которое уничтожает молодые листья побегов;
- омолодить кусты роз, добавив в раствор бикарбоната немного нашатырного спирта;
- устранить мелкую траву, которая пробивается в расщелинах садовых дорожек;
- победить гусениц, поедающих молодые капустные листья;
- подкормить томаты, после чего их плоды станут еще мясистее и слаще;
- подкислить почву для выращивания некоторых видов культурных растений;
- защитить виноградные гроздья от серой гнили и сделать ягоды более сахаристыми;
- очистить руки после работы в саду от крепко въевшейся в них грязи.
Применение в медицине
Содовый раствор – настоящий спаситель от многих заболеваний. Некоторые врачи даже настаивают на том, что двууглекислый натрий способен вылечить рак.
 Полоскание раствором соды очень быстро и ощутимо снимает неприятные ощущения в горле
Полоскание раствором соды очень быстро и ощутимо снимает неприятные ощущения в горлеОднако, пока исследования по действию соды на онкопатологию еще продолжаются, можно с уверенностью сказать, что данное вещество способно справиться со многими недугами:
- изжогой – средство нейтрализует повышенную кислотность;
- простудой – гидрокарбонат натрия способен снять первые симптомы простуды и предотвратить развитие заболевания;
- опрелостями у грудничков – раствор способствует быстрому заживлению ранок на поверхности кожи;
- циститом – сода в растворенном состоянии помогает организму бороться с патогенными микроорганизмами;
- ожогами – раствор двууглекислого натрия, нанесенный на пораженное место, снимает боль, а раны быстрее затягиваются;
- гипертонией – гидрокарбонат натрия помогает вывести лишнюю воду и существенно понизить артериальное давление;
- насморком – простой раствор из соды и соли прекрасно заменяет дорогостоящие аптечные препараты, а промывать им нос можно сколько угодно без вреда для здоровья;
- молочницей – при помощи гидрокарбоната натрия можно избавиться от ненавистной для женщин молочницы, поскольку грибок Кандида боится щелочной среды;
- затяжным кашлем – при помощи растворенной в молоке соды и меда можно избавиться от длительного сухого кашля, поспособствовать отхождению мокроты;
- ангиной – полоскания горла содовым раствором смягчают проявления заболевания, способствуют отхождению гнойных пробок и очищению горла, также при отхождении гноя значительно понижается температура тела и человеку становится значительно лучше;
- дерматитом и псориазом – содовые примочки чрезвычайно благотворно действуют на пораженную поверхность кожи;
- мозолями, фурункулами и натоптышами, на поверхность которых прикладывается ватка, смоченная в приготовленном средстве;
- табакокурением – при помощи раствора гидрокарбоната натрия курильщики полощут рот;
- шлаками и токсинами, которые растворенная в воде сода успешно выводит из организма;
- проявлениями укачивания в транспорте.
Применение в косметологии
Чтобы придать секущимся волосам красоту и силу, можно воспользоваться средством с бикарбонатом, сделанным прямо перед процедурой мытья головы. Для этого 2 ч. л. соды нужно добавить в 3 ст. л. шампуня, чтобы получилось достаточно крепкое концентрированное средство. Таким шампунем моют голову один раз в неделю, а в другое время применяют обычные моющие средства. Уже через месяц можно заметить, что волосы набирают силу, меньше секутся, становятся густыми и блестящими.
Также гидрокарбонат натрия можно смешивать и с гелем для тела, чтобы сделать своеобразный скраб и слущивать с тела отмершие частички эпидермиса. Это поможет придать коже более здоровый вид.
При помощи двууглекислого натрия можно восстановить кислотный баланс кожи, и таким образом устранить прыщи на ее поверхности. Для этого ватный тампон окунают в соду и протирают лицо два раза в неделю. Протирать кожу лица нужно очень мягко, массирующими движениями, избегая области под глазами. Если делать процедуру регулярно, то прыщи на поверхности кожного покрова не появятся долгое время.
Чтобы успешно применять соду, очень важно обратить внимание на то, как сделать раствор правильно. Не стоит смешивать на глаз пропорции и считать, что такое средство станет помощником – во многих случаях именно превышение дозы основного вещества становилось причиной аллергических реакций или ухудшения состояния больного. А в садоводстве слишком крепкий раствор кальцинированной соды и вовсе способен погубить урожай.
sodalab.ru